18015531058
清阳工程通过对各行业无尘车间的深入研究和工程经验积累,了解洁净车间环境控制的关键
从标准、专业、系统、节能、智能、便捷等方面综合打造先进的无尘洁净空间工程
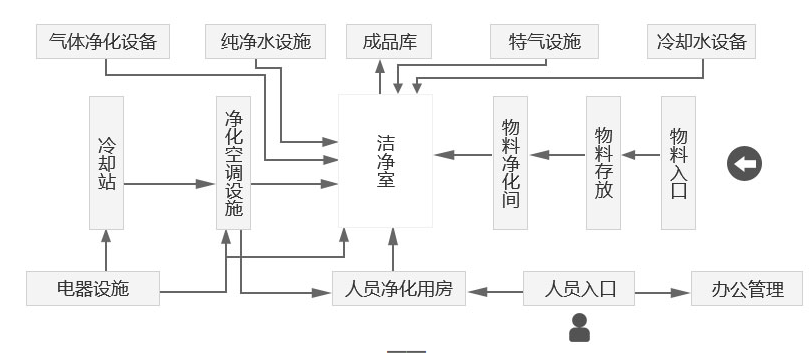
提供从洁净空间规划设计、人流物流净化方案、洁净车间建筑装饰系统、空气净化系统、空调制冷系统、纯水系统、特殊气体系统、电气系统、给排水系统、自控系统、空压系统、废水废气系统、等全面净化无尘厂房装修工程及装配套安装服务.
无菌医疗器具洁净室空气洁净度等级表
洁净度级别 | 尘粒最大允许数,个/m³ | 微生物最大允许数 | ||
≥0.5μm | ≥5.0μm | 沉降菌,个/皿 | 浮游菌,个/m3 | |
100级 | 3500 | 0 | 1 | 5 |
10000级 | 350000 | 2000 | 3 | 100 |
100000级 | 3500000 | 20000 | 10 | 500 |
300000级 | 10500000 | ≤60000 | 15 | -- |
药品洁净室空气洁净度等级表
洁净度级别 | 悬浮粒子最大允许数/立方米 | |||
静态 | 动态 | |||
≥0.5μm | ≥5.0μm | ≥0.5μm | ≥5.0μm | |
A级 | 3520 | 20 | 3520 | 20 |
B级 | 3520 | 29 | 352000 | 2900 |
C级 | 352000 | 2900 | 3520000 | 29000 |
D级 | 3520000 | 29000 | 不作规定 | 不作规定 |
生物制药无菌车间:
生物制药无菌车间同传统的洁净室是存在一定的差异的,尤其是对于生物制药车间来说,对于内部的设施和人员的要求非常高。在这一点上,GMP生物制药车间同传统的洁净车间就明显的区分开来,传统的洁净室可能主要注重的就是室内的洁净度就可以;而生物制药则更多的则是要考虑空气中的微生物的化学性、放射性等等因素,因为这些数据是洁净度检测中无法发现的。全国服务热线:18915730122 在线咨询
制药厂主要有片剂,胶囊剂,口服酊膏剂,口服丸剂,口服颗粒、粉、散剂,外用酊、膏、贴、粉剂,外用涂剂、栓剂,注射剂,兴奋剂,麻黄碱制剂等产品;
药品质量符合规定不仅是产品质量符合注册质量标准,还应使其全过程符合《药品生产质量管理规范》;
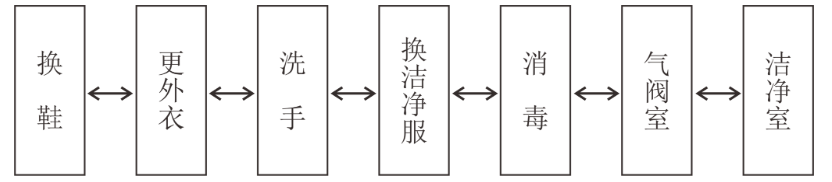
人员净化:生物医药洁净室(区)的人员净化程序宜按下图布置
生物制药企业要求无菌GMP的目标是确保建立科学的、严格的无菌药品生产环境、工艺、运行和管理体系,较大限度地消除所有可能的、潜在的生物活性、灰尘、热原污染,生产出高品质的、卫生安全的药物产品。所说的生物制药净化工程-GMP洁净厂房工程解决方案和污染控制技术就是保证MP成功实施的的主要手段之一。
通过对生物制药客户生产环境的深入研究和工程经验积累,清阳清楚了解生物制药生产过程环境控制的关键。
节能是清阳净化系统方案优先考虑的重点,我们擅长的就是给予客户符合(MPB及red 209D、IS0144、 IET、E12国际标准要求,同时应用了全新节能技术的环境解决方案;
清阳可以提供从GMP整厂规划设计--人流物流净化方案、洁净空调系统、洁净装饰系统;整厂节能改造、水电、超纯气体管道、洁净室监测、维护系统等全面安装配套服务;欢迎您的咨询:18915730122(微信同号)
医疗器械净化工程-无菌洁净室工程设计的规范参照:
1、国际标准《ISO/DIS 14644》
2、洁净室厂房设计规范《GB50073-2001》
3、医疗器械包装车间洁净室厂房规范《GMP-97》
4、药品生产质量管理规范《GMP-98》
5、洁净室施工及难收规范《JGJ 71-90》
6、通风与空调工程施工及验收规范《GB 50243-2002》
7、美国联邦标准《FS209E-92》

在洁净室建设或改建时,不能依赖于最终的竣工验收来保证洁净室的质量,必须从设计及设备选型阶段就严格把关,在建设的全过程中对主要关键点严格检查、监督,在实际使用中定期监测才能保证洁净室达到设计指标和使用要求.无菌医疗器械是任何标明“无菌”的医疗器械,生产洁净室是保证无菌医疗器械质量的基本条件,控制无菌医疗器械生产过程的环境并规范其生产,防止环境对无菌医疗器械污染,洁净室必须满足规定环境参数的要求来建设和定期监测。
清阳生物制药洁净车间装修净化工程覆盖:无菌实验、外用药剂、内服试剂、外用手术器材、植入式手术器材等制药厂、一类、二类、三类医疗器械行业;等各行业医疗药品保健食品GMP等车间装修工程;
清阳生物制药洁净车间装修洁净等级涵盖:十万级,万级,千级,百级,十级等洁净等级,A级,B级,C级,D级各等级无菌超净间装饰装修工程;
清阳医疗器械GMP净化工程项目覆盖范围有上海,江苏,浙江,安徽,河南,山东等多地,累积超过30万平无菌厂房面积,300多家企业选择清阳工程;
清阳客户80%回头率&75%转介绍率,为各行业业主提供净化厂房装修服务,价格1步到位!
清阳工程17年专业净化装修资质+消防资质+机电安装,打造的无尘车间平稳运行15年无压力;

清阳工程不仅仅是无尘车间的施工方,更是为您企业安心投产的保险方!
消防设施工程专业承包2级、建筑装修装饰工程专业承包2级、建筑机电安装工程专业承包2级资质;




工程管理团队 专业管理团队+专业施工人员,持证上岗


工程细节&隐蔽工程 规范施工,隐蔽工程细节处拒绝敷衍了事


无尘车间装修早知道,选择净化工程公司方法(避免入坑)
①、不知道怎么着净化工程公司报价?---一定要有资质!专业净化工程公司都有机电安装资质;
②、对无尘车间施工一无所知?----先结合行业标准与企业自身实际需求定方案;
③、对无尘车间质保及售后服务不了解?不知道规避风险?----避免中间商转包带来的沟通服务不便;
④、对工程所用的主要材料有哪些不清楚,对其质量及品牌不放心?----按预算,选择相应价位品牌;结合日后维护与节能方面;
⑤、核心设备后续维护是否便捷?----清阳为您从设计开始,从使用寿命与维护便捷入手选材;
⑥、洁净不达标,GMP验收不合格----清阳洁净度可以达到或者超过要求标准交付,很多公司洁净度不达标多次找清阳给解决案;
⑦、工程建设行业乱象---价格低恶性竞争拿下项目,方案没从客户实际需求做详细或特意漏项,后面靠增项收取费;
---清阳可以免费提供无尘车间设计方案:价格及细则一目了然,解决您的所有困扰 ---
欢迎您的咨询:18915730122(微信同号)

【资质】清阳具备国家住建部签发的机电三级资质,施工二级资质,安全生产许可证,网上可查询;
【经验】17年服务经验,做过超过百家设计电子,医疗,生物,制药,精密机械,食品,化妆品等多个行业;
【专业】拥有自己设计及施工团队,含有电工,焊工,起重工等多特种技工,持证上岗,专人负责;多个先进测试设备,为需要认证的净化项目保驾护航;
【口碑】我司成立于2007年,至此300多个项目实操经验,诚信守法;
【价格】我们拥有自己的净化产品生产线,价格优势游于很多同行;



17年优胜劣汰选择供应商-清阳坚信-材料和设备决定工程品质

①在核心净化设备上除采用品牌空调,清阳工程自有净化设备研发团队及工厂,自主研发生产新型FFU高效过滤器;

清阳掌握净化核心,让洁净更节能 !更为您省电费
②地坪及墙板工程,清阳工程经过多年的筛选,选用的材料材质经得起时间的检验;让您的车间耐用,美观大气!


欢迎微信咨询客服;工程服务热线:18915730122

掌握核芯,必达标
公司自有净化核心产品初中高效过滤器产线,产品自己研发及生产,减少核心部件的不稳定性,保障洁净度,使用寿命长,运营成本更低!
免费勘查,合理设计
现场免费勘查,根据需求设计,可出合理的结解决方案
17年精选供应商
精选知名频卖设备及材料供应商,让项目工程高质量完成,诚信经营,性价比高,工期有保障
有证·专业,团队才有底气
专业工程师证书,施工人员持证上岗,电工证、焊工证、起重工证等证书齐全
1对1项目跟踪管理,施工有保障
严格执行国家标准,符合建筑规范,做良心工程,杜绝隐患;采用1对1项目管理,保障施工现场全程服务;

---江浙沪皖8小时到现场勘查,24小时出设计方案 ---
清阳净化谨以专业、专注、专心、品质、节能为生存格言自成立之日起一直在洁净领域努力探索积累,
我们在行业的定位-空气洁净领域的探索者-CAE(Clean Air Explorer空气洁净领域的探索者)也因此而生,
我们一直在洁净室工程领域不断探索前行,目前公司已经累积了电子、微电子、半导体、实验室、
LCD-TFT、医药、医疗、激光、印刷、光学、化学、生物、食品、化妆品、相关行业的厂房净化装修成功案例,
有系统完善的行业整体解决方案、并有整体系统服务体系为保障和丰富的实施经验。
欢迎您的咨询:18915730122(微信同号)


清阳无尘车间客户名录(部分)

无尘车间装修早知道,选择净化工程公司方法(避免入坑)
①、不知道怎么着净化工程公司报价?---一定要有资质!专业净化工程公司都有机电安装资质;
②、对无尘车间施工一无所知?----先结合行业标准与企业自身实际需求定方案;
③、对无尘车间质保及售后服务不了解?不知道规避风险?----避免中间商转包带来的沟通服务不便;
④、对工程所用的主要材料有哪些不清楚,对其质量及品牌不放心?----按预算,选择相应价位品牌;结合日后维护与节能方面;
⑤、核心设备后续维护是否便捷?----清阳为您从设计开始,从使用寿命与维护便捷入手选材;
⑥、洁净不达标,GMP验收不合格----清阳洁净度可以达到或者超过要求标准交付,很多公司洁净度不达标多次找清阳给解决案;
⑦、工程建设行业乱象---价格低恶性竞争拿下项目,方案没从客户实际需求做详细或特意漏项,后面靠增项收取费;
---清阳可以免费提供无尘车间设计方案:价格及细则一目了然,解决您的所有困扰 ---

【资质】清阳具备国家住建部签发的机电三级资质,施工二级资质,安全生产许可证,网上可查询;
【经验】17年服务经验,做过超过百家设计电子,医疗,生物,制药,精密机械,食品,化妆品等多个行业;
【专业】拥有自己设计及施工团队,含有电工,焊工,起重工等多特种技工,持证上岗,专人负责;多个先进测试设备,为需要认证的净化项目保驾护航;
【口碑】我司成立于2007年,至此400多个项目实操经验,诚信守法;
【价格】我们拥有自己的净化产品生产线,价格优势碾压很多同行;



17年优胜劣汰选择供应商-清阳坚信-材料和设备决定工程品质

①在核心净化设备上除采用品牌空调,清阳工程自有净化设备研发团队及工厂,自主研发生产新型FFU高效过滤器;

清阳掌握净化核心,让洁净更节能 !更为您省电费
②地坪及墙板工程,清阳工程经过多年的筛选,选用的材料材质经得起时间的检验;让您的车间耐用,美观大气!


欢迎微信咨询客服;服务热线:18915730122

掌握核芯,必达标
公司自有净化核心产品初中高效过滤器产线,产品自己研发及生产,减少核心部件的不稳定性,保障洁净度,使用寿命长,运营成本更低!
免费勘查,合理设计
现场免费勘查,根据需求设计,可出合理的结解决方案
17年精选供应商
精选知名频卖设备及材料供应商,诚信经营,性价比高,工期有保障
有证·专业,团队才有底气
专业工程师证书,施工人员持证上岗,电工证、焊工证、起重工证等证书齐全
1对1项目跟踪管理,施工有保障
严格执行国家标准,符合建筑规范,做良心工程,杜绝隐患;采用1对1项目管理,保障施工现场全程服务;


---江浙沪皖8小时到现场勘查,24小时出设计方案 ---
清阳净化谨以专业、专注、专心、品质、节能为生存格言自成立之日起一直在洁净领域努力探索积累,
我们在行业的定位-空气洁净领域的探索者-CAE(Clean Air Explorer空气洁净领域的探索者)也因此而生,
我们一直在洁净室工程领域不断探索前行,目前公司已经累积了电子、微电子、半导体、实验室、
LCD-TFT、医药、医疗、激光、印刷、光学、化学、生物、食品、化妆品、相关行业的成功案例,
有系统完善的行业整体解决方案、并有整体系统服务体系为保障和丰富的实施经验。
欢迎您的咨询:18915730122(微信同号)

下一篇: 已经没有了
上一篇: 已经没有了